Năm 2003 là một năm quan trọng của y sinh học phân tử, khi toàn bộ gen người “human genome” được công bố hoàn thiện.
LƯỢC SỬ LIỆU PHÁP GEN
Trong khoảng 5-10 năm kế tiếp, các bác sĩ nhiều chuyên khoa kết hợp với nhà di truyền học đã tiến hành khảo sát hàng loạt các bệnh di truyền đơn gen hoặc đa gen. Kết quả cho ra một lượng lớn dữ liệu được kết nối với nhiều viện và trung tâm nghiên cứu mở rộng số lượng mẫu mẫu bệnh (cả mô tươi và mô paraffin đã được lưu giữ nhiều năm trước). Việc tích hợp các thông tin từ bộ gen đã đem lại cho chúng ta một cái nhìn toàn diện về các vận hành bên trong của tế bào bệnh so với tế bào lành. Mặc dù vẫn còn nhiều nhiệm vụ khó khăn để cố gắng biện luận ý nghĩa của dữ liệu này, nhưng tất cả các nhà nghiên cứu và bác sĩ chuyên khoa hy vọng rằng nỗ lực tiếp theo sẽ giúp cải thiện phương pháp điều trị cho từng bệnh nhân hướng đến “personalized medicine”.
Hiện nay ước tính ở người có khoảng 27.000 gen. Chức năng của sinh học thể hiện qua dòng thông tin di truyền từ DNA →RNA→ protein. Trong đó phần lớn các kiểu hình trung gian quy định sinh học của tất cả các bệnh do protein được mã hóa từ thông tin di truyền DNA. Do đó bất kỳ sự khác biệt trong trình tự DNA có thể thay đổi kiểu hình gây bệnh. Những cấu trúc đã được tìm thấy do chúng đóng vai trò như enzyme ví dụ như ribozyme (Nobel y khoa 1989 – GS. Sidney Altman, ĐH Yale, và GS Thomas Cech).
NHỮNG THAY ĐỔI CỦA LIỆU PHÁP TẾ BÀO
Nếu việc truyền tải gen vào trong tế bào là có tiềm năng ích lợi nhưng có nhiều thách thức về mặt kỹ thuật, tế bào gốc lành cấy ghép là một khái niệm mới? Gần đây việc nhận ra rằng khả năng của việc tái lập trình “reprogramming” tế bào somatic thành tế bào gốc iPS (công trình Nobel Y học năm 2012 của nhóm nghiên cứu Nhật Bản Shinya Yamanaka và nhóm người Anh Sir. John Gurdon) đã mở ra một viễn cảnh mới hoàn toàn cho các phương pháp điều trị tiềm năng trên tế bào gốc. Để hiểu được nghiên cứu này, chúng ta cần một chút cơ bản của sự phát triển sinh học, và chúng ta cần cân nhắc khái niệm tế bào gốc.
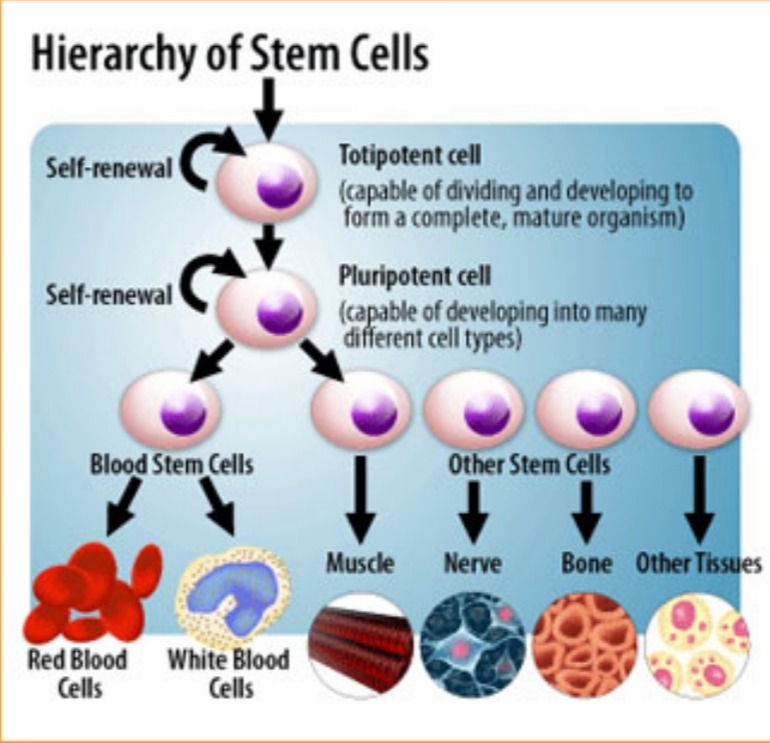
Thực chất, một tế bào gốc là một tế bào có khả năng tự làm mới, và có chức năng tái lập trình thành các dạng tế bào khác sau một kích thích tương ứng. Có rất nhiều loại tế bào gốc. Tế bào mẹ của tất cả các tế bào gốc là phôi một tế bào được tạo thành bởi sự dung hợp giữa tinh trùng và trứng, mang bên trong là tiềm năng bám vào tử cung và hình thành một đứa trẻ. Tế bào gốc như vậy gọi là “toàn năng” (totipotent). Khi phôi người phân chia thành 2 tế bào, sau đó 4, và 8, khả năng toàn phần này chỉ tồn tại ngắn. Ở thời gian mà 100 tế bào xuất hiện, những tế bào này biệt hóa thành một vài tế bào có thể quyết định kiến tạo nên cơ thể hoàn chỉnh của thai nhi,. Các tế bào này được gọi là vạn năng (pluritotent). Các thí nghiệm với chuột suốt nhiều thập kỷ chỉ ra rằng các tế bào này có thể sinh trưởng vô hạn định trong phòng thí nghiệm và duy trì tính vạn năng.
Thế còn người trưởng thành? Không có tế bào gốc toàn năng hoặc vạn năng tồn tại rõ ràng ở người trưởng thành, nhưng các dạng khác của tế bào gốc thực tế tồn tại ở nhiều khoang cơ thể, đáng chú ý nhất là tủy xương. Các tế bào này bị giới hạn nhiều về khả năng biệt hóa thành nhiều dạng tế bào khác, và vì vậy được gọi là đa năng (multipotent). Sự tồn tại các tế bào gốc ở người trưởng thành làm cho việc ghép tủy là có thể từ một người cho đến một người nhận, tái lập lại toàn thể sự tạo máu và hệ miễn dịch của người nhận bởi tế bào gốc đa năng cho bởi người cho. Có một đề nghị rằng tế bào gốc tủy xương trưởng thành có thể biệt hóa thành các mô khác, và có lẽ đóng góp cụ thể nhất cho y học là việc sửa chữa thay thế tế bào cơ tim hoặc thay thế thần kinh cảm giác và vận động.
Nếu các tế bào gốc đa năng có thể lấy từ chính bệnh nhân thì sau đó không cần thiết phải ức chế rào cản miễn dịch. Đó là trường hợp cừu Dolly. Nhân bản vô tính được tạo ra bởi quá trình ‘chuyển nhân tế bào sinh dưỡng’ “somatic cell nuclear transfer” (SCNT). Với quá trình này ,một tế bào động vật trưởng thành có chứa toàn bộ bộ gen của con vật đó (thường là tế bào da, nhưng đối với Dolly đó là tế bào vú), được biệt hóa thành tế bào gốc toàn năng. Quy trình được thực hiện bằng cách chuyển nhân của tế bào da hay tế bào vú vào bên trong một tế bào trứng đã bị loại bỏ nhân. Các tín hiệu từ tế bào chất của tế bào trứng bằng cách nào đó có thể tái thiết lập chương trình cho DNA nhân tế bào. Trong trường hợp của Dolly, tế bào này được cấy vào bên trong tử cung của một con cừu khác và sinh ra cừu Dolly có đặc tính di truyền của con cừu cho ban đầu. Quá trình sinh sản vô tính này đã tác động mạnh mẽ trên toàn thế giới 20 năm trước, và thực hiện thành công trên bò, ngựa, mèo, và chó. Tuy nhiên, vấn đề gây trở ngại là thực hiện chương trình tái thiết lập tế bào gốc toàn năng này ở người.
Nhiều quan ngại sâu sắc về mặt đạo đức liên quan đến khả năng SCNT có thể tạo ra một tế bào toàn năng để cấy vào trong tử cung của một người phụ nữ và được sử dụng để sinh sản vô tính người, tạo ra “bản sao” của một cá thể sống. Theo ý kiến của tất cả mọi người, những nhà khoa học cũng như những người không làm khoa học, điều này là phi đạo đức. Thứ nhất, điều này là không an toàn vì hầu như những động vật sinh sản vô tính (gồm cả cừu Dolly) đều biểu hiện một bất thường nào đó (trường hợp của cừu Dolly đã mắc phải bệnh viêm khớp, béo phì và đã chết sớm). Thứ hai, điều này sẽ làm gia tăng những lo ngại về gánh nặng của những kỳ vọng được đặt lên “dòng vô tính” mới và không được dễ dàng chấp thuận về mặt đạo đức. Cuối cùng, đây là vấn đề lo lắng thực sự bởi con người phải là sản phẩm của sự kết hợp giữa tinh trùng và trứng.
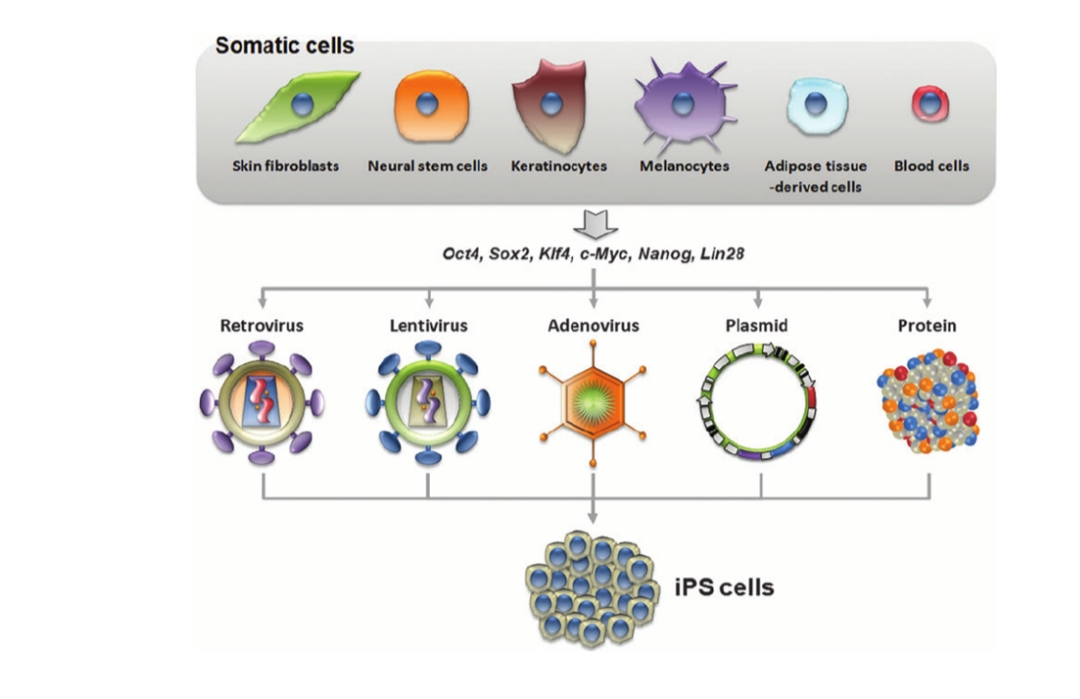
Nhưng phải chăng sản phẩm của một dòng tế bào gốc người toàn năng tạo bởi SCNT tự bản thân nó là phi đạo đức? sự tiến bộ mới đã có những khám phá thật ấn tượng, có thể cung cấp những giải pháp mạnh mẽ cho cả vấn đề thực tiễn và đạo đức. Đó là công trình của nhóm khoa học làm việc ở Nhật Bản, GS. Shinya Yamanaka đã mở ra hướng mới từ ý tưởng trên tế bào soma của SCNT. Đây là một phát triển khoa học có đủ khả năng hình thành một cuộc cách mạng thực sự trong y khoa. Khi bài báo của Yamanaka năm 2006 được công bố, báo cáo về khả năng chuyển bốn yếu tố (Oct4, Sox2, cMyc và Klf4) vào tế bào da chuột để kích hoạt chúng trở thành tế bào gốc đa năng, và tế bào này có thể biệt hóa thành hầu như tất cả các loại mô chuột như gan, mỡ, cơ, thần kinh… Chỉ một năm sau đó, Yamanaka và một nhóm khác đã báo cáo điều tương tự thực hiện trên các tế bào da người; và gần đây nhất họ đã công bố có thể thực hiện được điều này mà chỉ cần một tế bào lấy từ tóc người. Loại tế bào mới này, tế bào gốc đa năng cảm ứng “Incduced pluripotent stem cell” (iPS) đã mở ra một cánh cửa mới cho nghiên cứu và các ứng dụng tiềm năng cho lâm sàng. Từ những thành tựu này Yamakana cùng với B. Gurdon người Anh(Năm 1962, chứng minh sự biệt hoá của các tế bào thì đảo ngược được) đạt giải Nobel Y học năm 2012. iPS làm nhẹ cuộc tranh cãi y đức. “Yamanaka đã gạt bỏ được nỗi lo y đức của việc nghiên cứu tế bào từ thai phôi, rẽ sang lối đi nghiên cứu được mọi người chấp nhận” – giám đốc trung tâm thực hành Y đức đại học Oxford nhận định
Ca cấy ghép tế bào nguồn gốc từ iPS đầu tiên cho mục đích trị liệu được tiến hành trên mô hình chuột mang bệnh hồng cầu hình liềm chỉ một năm sau khi tế bào iPS được công bố. Từ thời điểm đó, một vài thí nghiệm đã nhấn mạnh vai trò của công nghệ tế bào iPS trong y học tái sinh ở mức độ tiền lâm sàng. Bảng 1 báo cáo tóm tắt những báo cáo quan trọng nhất về vấn đề này. Nhiều nghiên cứu đã mô tả sự dung nạp thành công của tế bào cấy ghép và mức độ phục hồi kiểu hình bệnh. Ví dụ như, tế bào thần kinh dopaminergic tái biệt hóa từ tế bào iPS được thu nhận từ bệnh nhân Parkinson sống sót được trong não loài gặm nhấm trưởng thành và cải thiện tình trạng vận động bất đối xứng trên những con chuột bị Parkinson. Trong mô hình tổn thương cột sống, Nori và cộng sự đã xác nhận rằng không chỉ nhờ những tế bào được cấy ghép mà còn có sự biệt hóa của chúng thành tế bào thần kinh trưởng thành và tái phát triển sợi trục thần kinh đã mang lại sự phục hồi chức năng. Trong một hướng nghiên cứu khác, tiến hành tái thiết lập chương trình đi kèm sửa chữa gene dystrophin trên tế bào iPS ex vivo nhằm để chữa trị bệnh loạn dưỡng cơ. Cơ của những con vật bị loạn dưỡng sau khi cấy ghép các tế bào đầu dòng cơ thu nhận từ iPS đã sửa chữa di truyền cho thấy sự cải thiện khả năng co giãn của chúng.
Một rào cản đáng chú ý khác là các quy trình nuôi cấy phức tạp được sử dụng để sản sinh, duy trì và biệt hóa cụm tế bào iPS và tác động của chúng lên tế bào. Gặp khó khăn trong các kỹ thuật để đạt các tiêu chuẩn GMP (Good Manufacturing Practice) và các tiêu chí lâm sàng, vì quy trình biệt hóa tế bào iPS thành nhiều kiểu tế bào khác nhau vẫn còn sử dụng một lượng lớn và đa dạng các yếu tố tăng trưởng cũng như nhiều điều kiện nuôi cấy.
Có nhiều quy trình kết hợp liệu pháp gen với các tế bào iPS. Chẳng hạn như, để điều trị bệnh thiếu máu hồng cầu hình liềm, một tế bào da lấy từ bệnh nhân được chuyển thành tế bào iPS và sau đó được “sửa chữa” với liệu pháp gen ex vivo để loại bỏ những đột biến hình liềm. Những tế bào này sau đó được xử lý trong phòng thí nghiệm để biệt hóa thành các tế bào gốc tủy xương và được truyền lại vào bệnh nhân ban đầu (có thể sau khi điều trị hóa trị liệu để “tạo khoảng trống” cho cấy tủy xương). Quy trình này nghe có vẻ như là khoa học viễn tưởng, nhưng đã được thực hiện thành công trên mô hình con chuột mắc bệnh hồng cầu hình liềm.
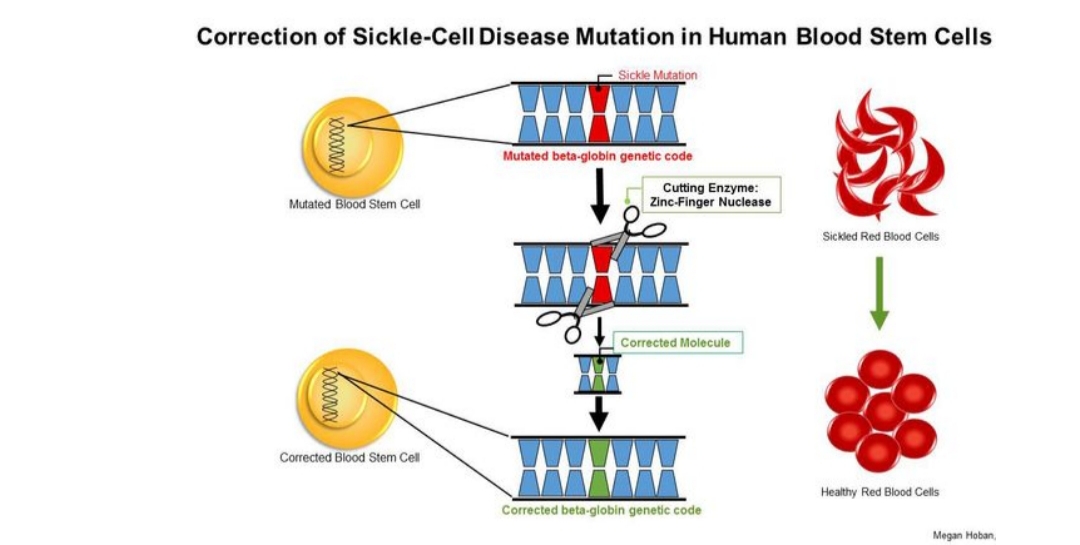
(https://newsroom.ucla.edu/releases/ucla-stem-cell-researchers-develop-promising-method-to-treat-sickle-cell-disease )
Các bệnh lý ung thư khác cũng vậy. Khi mà các tế bào đột biến thành tế bào ung thư thì nó sẽ có tính lẫn tránh với hệ thống miễn dịch của cơ thể, làm cơ thể chúng ta không tìm và tiêu diệt các tế bào ung thư, giảm thiểu số lượng tế bào miễn dịch là một trong các yếu tố làm tế bào ung thư tăng sinh vô hạn độ. Liệu pháp gen và tế bào, tiến hành tách chiết các tế bào iPS để biệt hóa thành các dòng tế bào miễn dịch và nuôi cấy chúng trong môi trường invitro, sau đó truyền lại vào chính cơ thể của bệnh nhân để làm nhiệm vụ đáp ứng miễn dịch dã mang lại những hiệu quả ban đầu khả quan trong tiên lượng và điều trị các bệnh lý ung thư
TRIỂN VỌNG CHO TƯƠNG LAI
Sự phát triển của hai liệu pháp này – liệu pháp gen và liệu pháp tế bào gốc, đặc biệt là iPS – mang lại những hứa hẹn đầy tiềm năng cho tương lai y học. Sự kết hợp những hứa hẹn của chúng với tất cả những thành phần khác như y học lâm sàng trong chẩn đoán, phòng ngừa và điều trị, hệ gen cá nhân dự báo trước một thay đổi lớn trong y học.
Cuối cùng, theo một lời nhắn nhủ của Saint-Exupéry:”As for the future, your task is not to foresee, but to enable it”, tạm dịch là “Trong tương lai, nhiệm vụ của bạn không phải để dự đoán trước mà là khởi động nó”. Đối với tương lai của y học cá thể hóa, lời nhắn nhủ này không chỉ dành cho cộng đồng khoa học, y tế hay chính phủ mà là dành cho mỗi người chúng ta. Y học cá thể hóa chỉ có thể thành công nếu mỗi người trong chúng ta chịu trách nhiệm về sức khỏe của mình. Những người chăm sóc sức khỏe sẽ giúp đỡ nhưng họ không thể “lái chiếc xe của bạn”. Bạn cần phải nâng cao tri thức của mình để hiểu rõ về cuộc cách mạng mới này.
Tài liệu tham khảo:
Proteomics và chức năng của proteomics – GS.TS Nguyễn Thị Lang, GS. TS Bùi Chí Bửu, TS. Bùi Chí Bảo – Nhà xuất bản giáo dục Việt Nam, 2013
The Languge of life – DNA and The Revolution in Personalized Medicine – Francis S. Collin
American Association for Cancer Research
www.aacr.org
American Society of Gene & Cell Therapy
www.asgct.org
Gene Therapy Net
www.genetherapynet.com
National Cancer Institute www.cancernet.nci.nih.gov www.cancer.gov cancertrials.nci.nih.gov
Oncolink – University of Pennsylvania
www.oncolink.upenn.edu
Whitehead Institute for Biomedical Research
www.wi.mit.edu
Ths.Bs. Nguyễn Thanh Toàn, Ts. Vũ Hồng Nam- Khoa Ung bướu- Bệnh viện Quân Y 175 -BQP


