Hiện nay, bệnh ung thư đang là gánh nặng cho kinh tế xã hội của mỗi quốc gia, ước tính hàng năm Việt Nam có khoảng 260.000 người mắc mới và 2/3 trong số đó tử vong. Hậu quả nó mang đến không chỉ là về kinh tế và còn về các vấn đề xã hội giáo dục….các biện pháp điều trị với mục tiêu là kéo dài thời gian tiến triển không bệnh bằng cách phối hợp các phương pháp điều trị đa mô thức kết hợp của ba phương pháp điều trị chính là Hóa trị, xạ trị, phẫu trị. Trong đó hóa trị là biện pháp toàn thân, tấn công vào chu trình sinh trưởng của tế bào, cả tế bào lành và tế bào ung thư
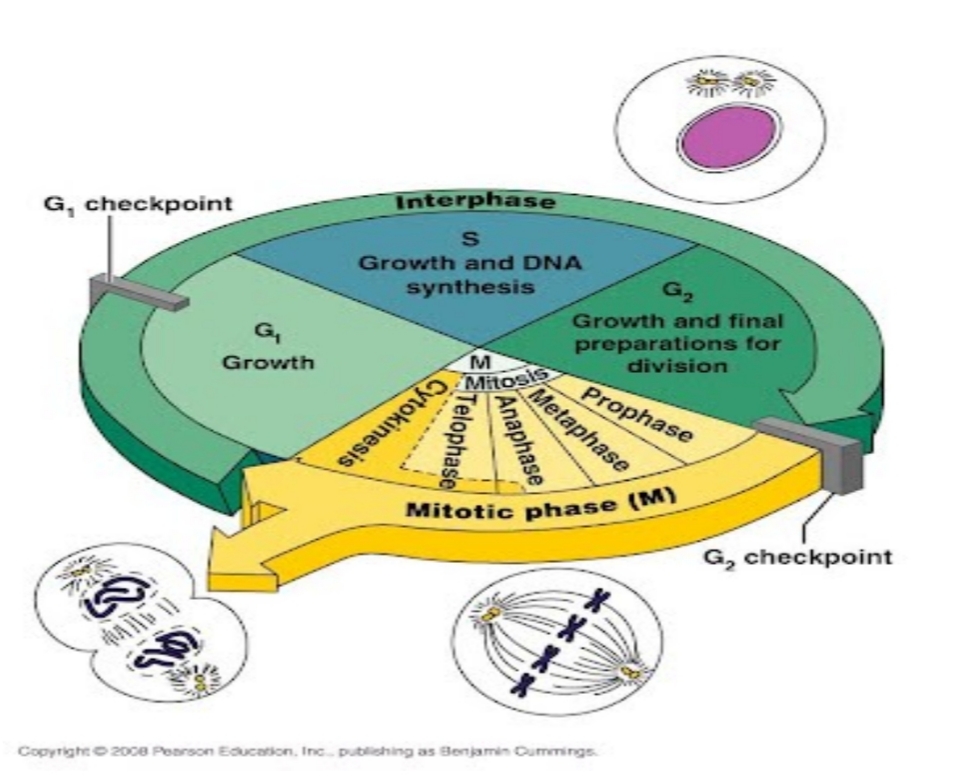 Do vậy, khi hóa trị một số tác dụng phụ mang đến cho bệnh nhân những rắc rối không đáng có như buồn nôn, nôn, rụng tóc, viêm da, viêm móng…các trường hợp bệnh nhân từ chối điều trị ung thư và cầu cứu một phương pháp “dân gian” cũng xuất phát từ đây mà ra. Bệnh nhân từ bỏ điều trị khi giai đoạn còn có thể kiểm soát để kéo dài sự sống của họ.
Do vậy, khi hóa trị một số tác dụng phụ mang đến cho bệnh nhân những rắc rối không đáng có như buồn nôn, nôn, rụng tóc, viêm da, viêm móng…các trường hợp bệnh nhân từ chối điều trị ung thư và cầu cứu một phương pháp “dân gian” cũng xuất phát từ đây mà ra. Bệnh nhân từ bỏ điều trị khi giai đoạn còn có thể kiểm soát để kéo dài sự sống của họ.
Năm 1986, một phát hiện mang tính chất lịch sử đưa con người tiếp cận gần hơn với liệu pháp điều trị ung thư dựa trên những hiểu biết mới về sự tăng trưởng của tế bào và các con đường tín hiệu dẫn truyền, đặc biệt là phát hiên ra đột biến trên gen kích thích tăng trưởng biểu mô (EGFR). Từ đó bào chế ra các thuốc tấn công vào bất thường này để giảm sự tăng trưởng khối ung thư mà không hoặc rất ít tấn công trên tế bào không ung thư. Phát hiện này đã giúp hai nhà khoa học Stanley Cohen, Rita Levi-Montalcini nhận giải thưởng Nobel Y học năm đó.
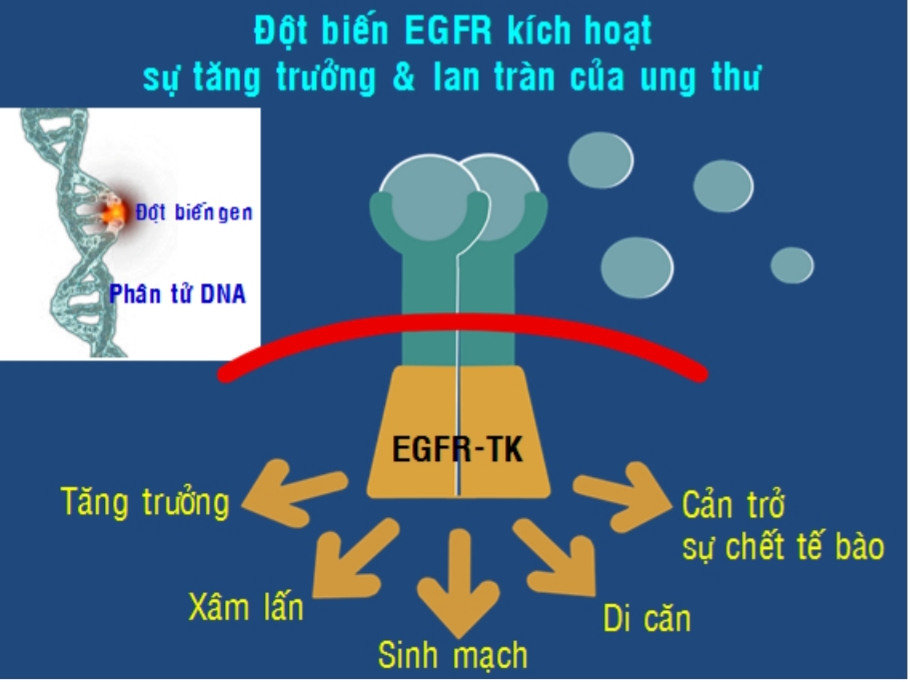 Từ những phát hiện đầu tiên này, con người đã tìm ra rất rất nhiều đột biến khác cũng ảnh hưởng đến sự tăng trưởng của tế bào ung thư hoặc là đột biến làm giảm sự đè nén ung thư của cơ thể người. Các thuốc điều trị trúng đích đến của ung thư được sản xuất hàng loạt mang lại niềm hy vọng cho bệnh nhân ung thư. Liệu pháp này được gọi là liệu pháp trúng đích (Target therapy)
Từ những phát hiện đầu tiên này, con người đã tìm ra rất rất nhiều đột biến khác cũng ảnh hưởng đến sự tăng trưởng của tế bào ung thư hoặc là đột biến làm giảm sự đè nén ung thư của cơ thể người. Các thuốc điều trị trúng đích đến của ung thư được sản xuất hàng loạt mang lại niềm hy vọng cho bệnh nhân ung thư. Liệu pháp này được gọi là liệu pháp trúng đích (Target therapy)
 Đó là các bệnh nhân phát hiện các đột biến và có thuốc điều trị trúng đích để dùng. Các bệnh nhân còn lại chiếm số đông hơn thì họ sẽ điều trị bằng phương pháp cổ điển hay tìm ra một phương pháp mới. Câu trả lời được tìm ra năm 2018, Hai nhà khoa học đã phát hiện rằng, hệ thống miễn dịch trong cơ thể người có thể được khai thác để tấn công các tế bào ung thư. Hệ thống miễn dịch thường phát hiện và tiêu diệt các tế bào đột biến, nhưng các tế bào ung thư lại tìm ra những cách phức tạp hơn để trốn khỏi các cuộc tấn công miễn dịch, nhờ đó chúng có thể tiếp tục phát triển. Nhiều loại ung thư đã làm như vậy bằng cách đẩy mạnh một cơ chế phanh, kiểm soát các tế bào miễn dịch. Phát hiện này đã tìm ra một phương pháp điều trị mà có thể kích hoạt hệ thống miễn dịch tự thân để điều trị ung thư, kiểm soát và tiêu diệt các tế bào ác tính. Để ghi nhận cho sự phát hiện này Giải thưởng Nobel Y học 2018 đã được trao cho hai nhà khoa học, James Allison (Mỹ) và Tasuku Honjo (Nhật Bản).
Đó là các bệnh nhân phát hiện các đột biến và có thuốc điều trị trúng đích để dùng. Các bệnh nhân còn lại chiếm số đông hơn thì họ sẽ điều trị bằng phương pháp cổ điển hay tìm ra một phương pháp mới. Câu trả lời được tìm ra năm 2018, Hai nhà khoa học đã phát hiện rằng, hệ thống miễn dịch trong cơ thể người có thể được khai thác để tấn công các tế bào ung thư. Hệ thống miễn dịch thường phát hiện và tiêu diệt các tế bào đột biến, nhưng các tế bào ung thư lại tìm ra những cách phức tạp hơn để trốn khỏi các cuộc tấn công miễn dịch, nhờ đó chúng có thể tiếp tục phát triển. Nhiều loại ung thư đã làm như vậy bằng cách đẩy mạnh một cơ chế phanh, kiểm soát các tế bào miễn dịch. Phát hiện này đã tìm ra một phương pháp điều trị mà có thể kích hoạt hệ thống miễn dịch tự thân để điều trị ung thư, kiểm soát và tiêu diệt các tế bào ác tính. Để ghi nhận cho sự phát hiện này Giải thưởng Nobel Y học 2018 đã được trao cho hai nhà khoa học, James Allison (Mỹ) và Tasuku Honjo (Nhật Bản).
Mặt khác, các tế bào ác tính có sự phát triển mạnh mẽ để phát triển các cách để thoát khỏi hệ thống miễn dịch. Một cơ chế phòng vệ bao gồm việc mô phỏng các tế bào bình thường bằng cách biểu hiện các protein checkphoit. Protein checkpoit là các phân tử bề mặt tế bào báo hiệu cho các tế bào T lưu thông rằng tế bào mang chúng là bình thường và không nên bị tấn công. Một ví dụ là protein PD-L1, được nhận ra bởi phân tử PD-1 trên các tế bào T; khi PD-L1 liên kết với PD-1 trên tế bào T, tế bào đó không bị tấn công. Liệu pháp điều trị ung thư bằng cách sử dụng các kháng thể đơn dòng ngăn chặn PD-L1 hoặc PD-1 (được gọi là chất ức chế checkpoit) do đó có thể cho phép hệ thống miễn dịch tấn công các tế bào ác tính trước khi có sự hiện diện của protein PD-L1. CTLA-4 là một protein checkpoit khác ngăn chặn sự tấn công của hệ thống miễn dịch và có thể bị chặn bởi một kháng thể. Bởi vì các protein checkpoit có thể có mặt trên các tế bào bình thường, liệu pháp ức chế điểm kiểm tra cũng có thể tạo ra hệ thống miễn dịch để tấn công các tế bào đó
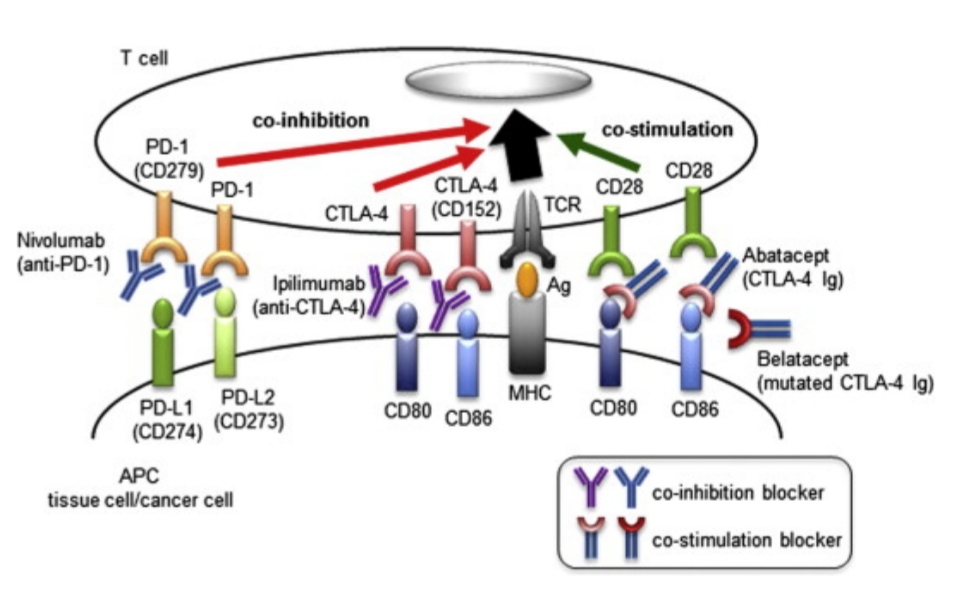 Việc này sẽ kích hoạt hệ thống miễn dịch của cơ thể đáp ứng lại tế bào ung thư, giúp hệ thống miễn dịch tiêu diệt tế bào ưng thư. Liệu pháp này là liệu pháp miễn dịch (Immuno therapy)
Việc này sẽ kích hoạt hệ thống miễn dịch của cơ thể đáp ứng lại tế bào ung thư, giúp hệ thống miễn dịch tiêu diệt tế bào ưng thư. Liệu pháp này là liệu pháp miễn dịch (Immuno therapy)
Cả hai phương pháp điều trị trúng đích và liệu pháp miễn dịch tưởng chừng như đã là những phương pháp rất tiến bộ trong điều trị ung thư. Tuy nhiên đây vẫn chỉ là các phương pháp nghiện cứu và ứng dụng trên những bệnh nhân có đột biến nói chung, có nghĩa là những bệnh nhân có đột biến EGFR sẽ dùng thuốc kháng TKI, những bệnh nhân có biểu hiện PD-L1 thì sẽ dùng liệu pháp miễn dịch. Trên từng cá thế có những quần thể bướu của mỗi bệnh nhân sẽ khác nhau có người có đột biến nhưng tỉ lệ thấp, đa phần còn lại là một quần thể có đặc tính khác. Hay liệu pháp miễn dịch, mỗi cơ thể người có khả năng miễn dịch khác nhau và “qui trình” trình diện kháng nguyên từ tế bào limpho dòng B sang dòng T cũng khác nhau. Vấn đề được đặt ra liệu có phương pháp nào tối ưu cho từng cá thể, ở đây được biết là mỗi người bệnh nhân. Một liệu pháp không chỉ tấn công vào chu trình sinh trưởng của tế bào, không chỉ tấn công vào cơ chế sinh bệnh ung thư chung cho các bệnh nhân có cùng đột biến, mà là một phương pháp được áp dụng cho mỗi cá thể bị mắc bệnh ung thư. Liệu pháp này được gọi là điều trị y học chính xác
Cơ sở khoa học cho liệu pháp điều trị này là sự phát hiện tác dụng của hiệu ứng “Abscopal”. Từ trước đến nay, Xạ trị được xem là phương pháp điều trị tại chỗ. Điều này có nghĩa là xạ trị tiêu diệt tế bào bướu bằng các bức xạ ion khi nó đi qua. Tuy nhiên gần đây đã có các nghiên cứu mới phát hiện ra rằng Xạ trị không chỉ có tác dụng có tại chỗ mà còn có một tác dụng tiêu diệt khối bướu thông qua hiệu ứng “Abscopal”, Hiệu ứng này được cho rằng khi chiếu tia xạ vào tế bào bướu không chỉ gây chết tế bào mà còn làm bọc lộ các kháng nguyên trên bề mặt của tế bào bướu, các kháng nguyên này được trình diện cho quá trình đáp ứng miễn dich tế bào trong đó quan trọng nhất là các CD8. Các CD8 này sẽ tìm và tiêu diệt các tế bào bướu có chung đặc điểm kháng nguyên bề mặt với các tế bào bướu đã bị tia xạ tiêu diệt
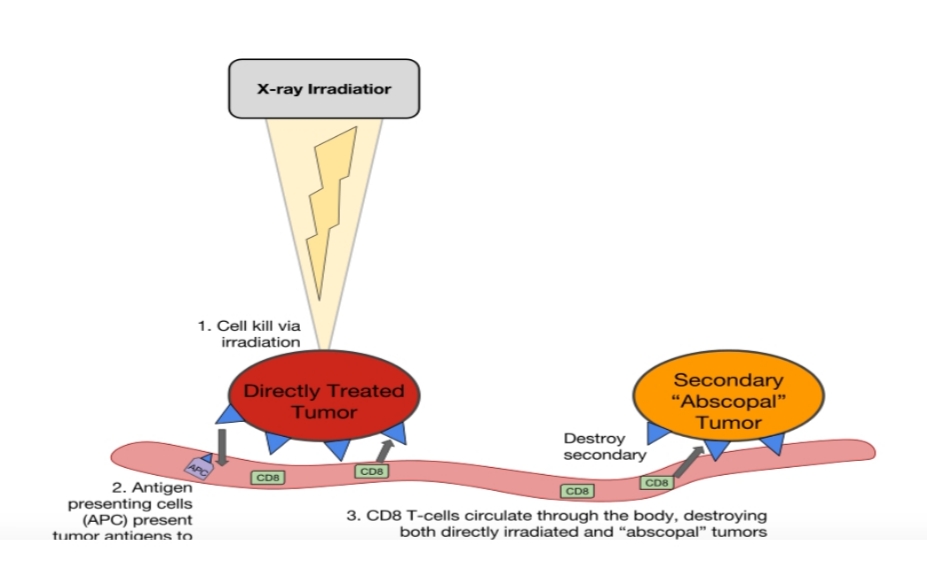 Cơ chế đề xuất của hiệu ứng abscopal, qua trung gian của hệ thống miễn dịch. Ở đây, bức xạ cục bộ gây ra cái chết của tế bào khối u, sau đó là sự nhận biết của hệ thống miễn dịch thích ứng, không khác gì vắc-xin. Đây là cơ chế gây chết tế bào bướu thông qua cơ chế miễn dịch trong cơ thể, các tế bào bướu lẫn tránh tế bào miễn dịch thông qua rất nhiều cơ chế trong đó có làm hoạt hóa PD1 trên bề mặt tế bào Limpho T, do vậy nếu kết hợp xạ trị làm tăng bọc lộ kháng nguyên bề mặt của tế bào bướu và sử dụng thuốc miễn dịch kháng PD1 hay PDL1 sẽ làm tăng hoạt hóa các tế bào miễn dịch sẽ tạo tác động kép tiêu diệt khối bướu
Cơ chế đề xuất của hiệu ứng abscopal, qua trung gian của hệ thống miễn dịch. Ở đây, bức xạ cục bộ gây ra cái chết của tế bào khối u, sau đó là sự nhận biết của hệ thống miễn dịch thích ứng, không khác gì vắc-xin. Đây là cơ chế gây chết tế bào bướu thông qua cơ chế miễn dịch trong cơ thể, các tế bào bướu lẫn tránh tế bào miễn dịch thông qua rất nhiều cơ chế trong đó có làm hoạt hóa PD1 trên bề mặt tế bào Limpho T, do vậy nếu kết hợp xạ trị làm tăng bọc lộ kháng nguyên bề mặt của tế bào bướu và sử dụng thuốc miễn dịch kháng PD1 hay PDL1 sẽ làm tăng hoạt hóa các tế bào miễn dịch sẽ tạo tác động kép tiêu diệt khối bướu
Mỗi bệnh nhân sẽ có đáp ứng miến dịch với một liều xạ khác nhau, không phải liều xạ càng cao là đáp ứng miến dịch càng cao và ngược lại mà theo một tác giả Zachary S. Buchwald(2018) cho rằng với một liều xạ lý tưởng thì số lượng tế bào trình diện kháng nguyên( APC) sẽ nhiều nhất và kích hoạt hệ thống miễn dịch tối ưu
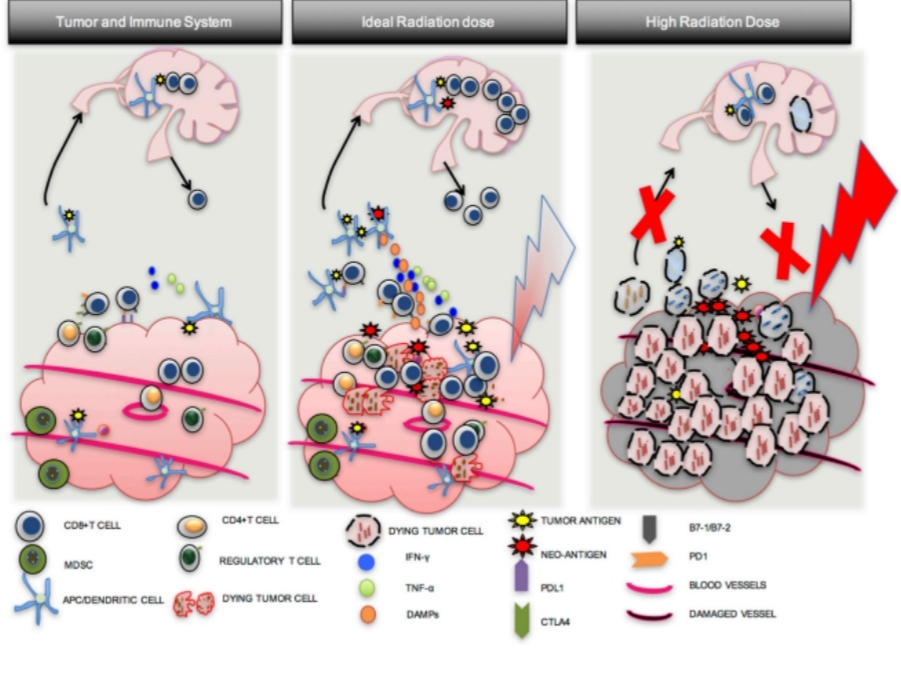 Đáp ứng miễn dịch với các liều xạ khác nhau
Đáp ứng miễn dịch với các liều xạ khác nhau
Khía cạnh khác của hiệu ứng “Abscopal” là tác dụng của các tế bào miễn dịch tiêu diệt khối bướu còn phụ thuộc vào yếu tố vi môi trường bướu bao gồm các phản ứng viêm và sự giải phóng các Cytokin hay các bổ thể có thể làm tăng hoặc giảm các tác dụng của hiệu ứng. Các yếu tố vi môi trường ảnh hưởng tới đáp ứng miễn dịch cũng như hiệu ứng Abscopal lên tế bào bướu bao gồm các yếu tố quan trọng IL-12p70, IL-8, IL-6, and TNF-α.
Một phương pháp điều trị ung thư mà dựa trên xác định các chỉ số cá thể của bệnh nhân như liều xạ tối ưu để sản sinh các CD8 miễn dịch, xác định các yếu tố vi môi trường bướu để thuận lợi nhất cho quá trình CD8 tiêu diệt các tế bào ung thư và liệu pháp nuối cấy tế bào miễn dịch đã qua trình diện kháng nguyên có thể được nghiên cứu áp dụng như là một phương pháp điều trị ung thư trong tương lai.
Với sự phát hiện ngày càng nhiều các đặc tính của khối u và những đáp ứng của cơ thể với khối u, con người đang tiệm cận dần đến phương pháp điều trị ung thư tốt nhất và đặt ra một hy vọng trong thời gian không xa, ung thư sẽ không còn là căn bệnh nan y mà nó sẽ được kiểm soát như một bệnh lý mãn tính trong rất nhiều những bệnh mạn tính khác trong đời sống con người.
ThS.BS Nguyễn Thanh Toàn. * Viện ung bướu và Y học hạt nhân – Bệnh viện Quân y 175, Giảng viên Khoa Điều dưỡng- Đại học
Văn Lang ĐT: 0973879905. E-mail: nguyentoan175@gmail.com
ThS.BSCK1. Nguyễn Như Ngọc, Viện ung bướu và Y học hạt nhân – Bệnh viện Quân y 175
TS.BS Vũ Hồng Nam, Viện ung bướu và Y học hạt nhân – Bệnh viện Quân y 175
Tài liệu tham khảo
- Ngwa W, Irabor OC, Schoenfeld JD, Hesser J, Demaria S, Formenti SC. (2018)Using immunotherapy to boost the abscopal effect. Nat Rev Cancer
- Zachary S. Buchwald1,2, Jacob Wynne1, Tahseen H. Nasti2, Simeng Zhu3,Waleed F. Mourad4, Weisi Yan5, Seema Gupta6, Samir N. Khleif6 and Mohammad K. Khan1*(2018) Radiation, Immune Checkpoint Blockade and the Abscopal Effect: A Critical Review on Timing, Dose and Fractionation
- Postow MA, Callahan MK, Barker CA, Yamada Y, Yuan J, Kitano S, et al. Immunologic correlates of the abscopal effect in a patient with melanoma. N Engl J Med. (2012) 366:925–31. doi: 10.1056/NEJMoa1112824
- Krummel MF, Allison JP. del CD28 and CTLA-4 have opposing effects on the response of T cells to stimulation. J Exp Med. (1995) 182:459–65. doi: 10.1084/jem.182.2.459
- Okazaki T, Maeda A, Nishimura H, Kurosaki T, Honjo T. del PD-1 immunoreceptor inhibits B cell receptor-mediated signaling by recruiting src homology 2-domain-containing tyrosine phosphatase 2 to phosphotyrosine. Proc Natl Acad Sci USA. (2001) 98:13866–71. doi: 10.1073/pnas.231486598
- Barber DL, Wherry EJ, Masopust D, Zhu B, Allison JP, Sharpe AH, et al. Restoring function in exhausted CD8 T cells during chronic viral infection. Nature (2006) 439:682–7. doi: 10.1038/nature04444
- Antonia SJ, López-Martin JA, Bendell J, Ott PA, Taylor M, Eder JP, et al. Nivolumab alone and nivolumab plus ipilimumab in recurrent small-cell lung cancer (CheckMate 032): a multicentre, open-label, phase 1/2 trial. Lancet Oncol. (2016) 17:883–95. doi: 10.1016/S1470-2045(16)30098-5
- Reck M, Rodríguez-Abreu D, Robinson AG, Hui R, Csoszi T, Fülöp A, et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N Engl J Med. (2016) 375:1823–33. doi: 10.1056/NEJMoa1606774
- Powles T, O’Donnell PH, Massard C, Arkenau HT, Friedlander TW, Hoimes CJ, et al. Efficacy and safety of durvalumab in locally advanced or metastatic urothelial carcinoma: updated results from a phase 1/2 open-label study. JAMA Oncol. (2017) 3:e172411. doi: 10.1001/jamaoncol.2017.2411
- Ascierto PA, Del Vecchio M, Robert C, Mackiewicz A, Chiarion-Sileni V, Arance A, et al. Ipilimumab 10 mg/kg versus ipilimumab 3 mg/kg in patients with unresectable or metastatic melanoma: a randomised, double-blind, multicentre, phase 3 trial. Lancet Oncol. (2017) 18:611–22. doi: 10.1016/S1470-2045(17)30231-0
- Leach DR, Krummel MF, Allison JP. Enhancement of antitumor immunity by CTLA-4 blockade. Science (1996) 271:1734–6. doi: 10.1126/science.271.5256.1734
- Ngwa W, Irabor OC, Schoenfeld JD, Hesser J, Demaria S, Formenti SC. Using immunotherapy to boost the abscopal effect. Nat Rev Cancer (2018) 18:313–22. doi: 10.1038/nrc.2018.6
- Kalbasi A, June CH, Haas N, Vapiwala N. Radiation and immunotherapy: a synergistic combination. J Clin Invest. (2013) 123:2756–63. doi: 10.1172/JCI69219
- Golden EB, Pellicciotta I, Demaria S, Barcellos-Hoff MH, Formenti SC. The convergence of radiation and immunogenic cell death signaling pathways. Front Oncol. (2012) 2:88. doi: 10.3389/fonc.2012.00088
- Buchwald ZS, Efstathiou JA. Immunotherapy and radiation – a new combined treatment approach for bladder cancer? Bladder Cancer (2015) 1:15–27. doi: 10.3233/BLC-150014
- Reits EA, Hodge JW, Herberts CA, Groothuis TA, Chakraborty M, Wansley EK, et al. Radiation modulates the peptide repertoire, enhances MHC class I expression, and induces successful antitumor immunotherapy. J Exp Med. (2006) 203:1259–71. doi: 10.1084/jem.200 52494
- Rescigno M, Granucci F, Ricciardi-Castagnoli P. Dendritic cells at the end of the millennium. Immunol Cell Biol. (1999) 77:404–10. doi: 10.1046/j.1440-1711.1999.00854.x
- Cao X. Self-regulation and cross-regulation of pattern-recognition receptor signalling in health and disease. Nat Rev Immunol. (2016) 16:35–50. doi: 10.1038/nri.2015.8
- Galluzzi L, Buqué A, Kepp O, Zitvogel L, Kroemer G. Immunogenic cell death in cancer and infectious disease. Nat Rev Immunol. (2017) 17:97–111. doi: 10.1038/nri.2016.107
- Pandolfi F, Altamura S, Frosali S, Conti P. Key role of DAMP in inflammation, cancer, and tissue repair. Clin Ther. (2016) 38:1017–28. doi: 10.1016/j.clinthera.2016.02.028
- Kono H, Rock KL. How dying cells alert the immune system to danger. Nat Rev Immunol. (2008) 8:279–89. doi: 10.1038/nri2215
- Obeid M, Tesniere A, Ghiringhelli F, Fimia GM, Apetoh L, Perfettini JL, et al. Calreticulin exposure dictates the immunogenicity of cancer cell death. Nat Med. (2007) 13:54–61. doi: 10.1038/nm1523
- Ghiringhelli F, Apetoh L, Tesniere A, Aymeric L, Ma Y, Ortiz C, et al. Activation of the NLRP3 inflammasome in dendritic cells induces IL-1betadependent adaptive immunity against tumors. Nat Med. (2009) 15:1170–8. doi: 10.1038/nm.2028
- Gameiro SR, Jammeh ML, Wattenberg MM, Tsang KY, Ferrone S, Hodge
- Radiation-induced immunogenic modulation of tumor enhances antigen processing and calreticulin exposure, resulting in enhanced T-cell killing. Oncotarget (2014) 5:403–16. doi: 10.18632/oncotarget.1719
- Wang L, He L, Bao G, He X, Fan S, Wang H. Ionizing radiation induces HMGB1 cytoplasmic translocation and extracellular release. Guo Ji Fang She Yi Xue He Yi Xue Za Zhi (2016) 40:91–9.
- Apetoh L, Ghiringhelli F, Tesniere A, Obeid M, Ortiz C, Criollo A, et al. Toll-like receptor 4-dependent contribution of the immune system to anticancer chemotherapy and radiotherapy. Nat Med. (2007) 13:1050–9. doi: 10.1038/nm1622
- Salmon H, Idoyaga J, Rahman A, Leboeuf M, Remark R, Jordan S, et al. Expansion and activation of CD103(+) dendritic cell progenitors at the tumor site enhances tumor responses to therapeutic PD-L1 and BRAF inhibition. Immunity (2016) 44:924–38. doi: 10.1016/j.immuni.2016.03.012
- Demaria S, Ng B, Devitt ML, Babb JS, Kawashima N, Liebes L, et al. Ionizing radiation inhibition of distant untreated tumors (abscopal effect) is immune mediated. Int J Radiat Oncol Biol Phys. (2004) 58:862–70. doi: 10.1016/j.ijrobp.2003.09.012


